¡OTRA PIEZA MÁS! CGG
Levadura Saccharomyces cerevisiae
Drosophila melanogaster
Frataxina
Acumulación de hierro
Toxicidad celular
Síndrome X frágil
Ratones transgénicos
Mus musculus/Rattus norvegicus
¿Qué sucede si los ponemos a todos en relación?
¿EXPLICAMOS CGGCGG? https://abs.twimg.com/emoji/v2/... draggable="false" alt="👇" title="Rückhand Zeigefinger nach unten" aria-label="Emoji: Rückhand Zeigefinger nach unten">
https://abs.twimg.com/emoji/v2/... draggable="false" alt="👇" title="Rückhand Zeigefinger nach unten" aria-label="Emoji: Rückhand Zeigefinger nach unten">
Levadura Saccharomyces cerevisiae
Drosophila melanogaster
Frataxina
Acumulación de hierro
Toxicidad celular
Síndrome X frágil
Ratones transgénicos
Mus musculus/Rattus norvegicus
¿Qué sucede si los ponemos a todos en relación?
¿EXPLICAMOS CGGCGG?
Partiendo de la intuición de @IagoNieto81  https://abs.twimg.com/emoji/v2/... draggable="false" alt="🤗" title="Umarmendes Gesicht" aria-label="Emoji: Umarmendes Gesicht"> sobre la levadura Saccharomyces cerevisiae como microorganismo unicelular que buscaría el SARs-CoV-2 para infectarlo, he puesto en relación los elementos implicados en todo un proceso de modulación genética de mutaciones.
https://abs.twimg.com/emoji/v2/... draggable="false" alt="🤗" title="Umarmendes Gesicht" aria-label="Emoji: Umarmendes Gesicht"> sobre la levadura Saccharomyces cerevisiae como microorganismo unicelular que buscaría el SARs-CoV-2 para infectarlo, he puesto en relación los elementos implicados en todo un proceso de modulación genética de mutaciones.
Al parecer esta levadura en concreto se usa como organismo modelo para realizar estudios de genómica comparativa. En ellos se ha observado cómo la carencia de proteína frataxina, FMR1, influye en la homeostasis, almacenamiento y maduración de procesos relacionados con el hierro.
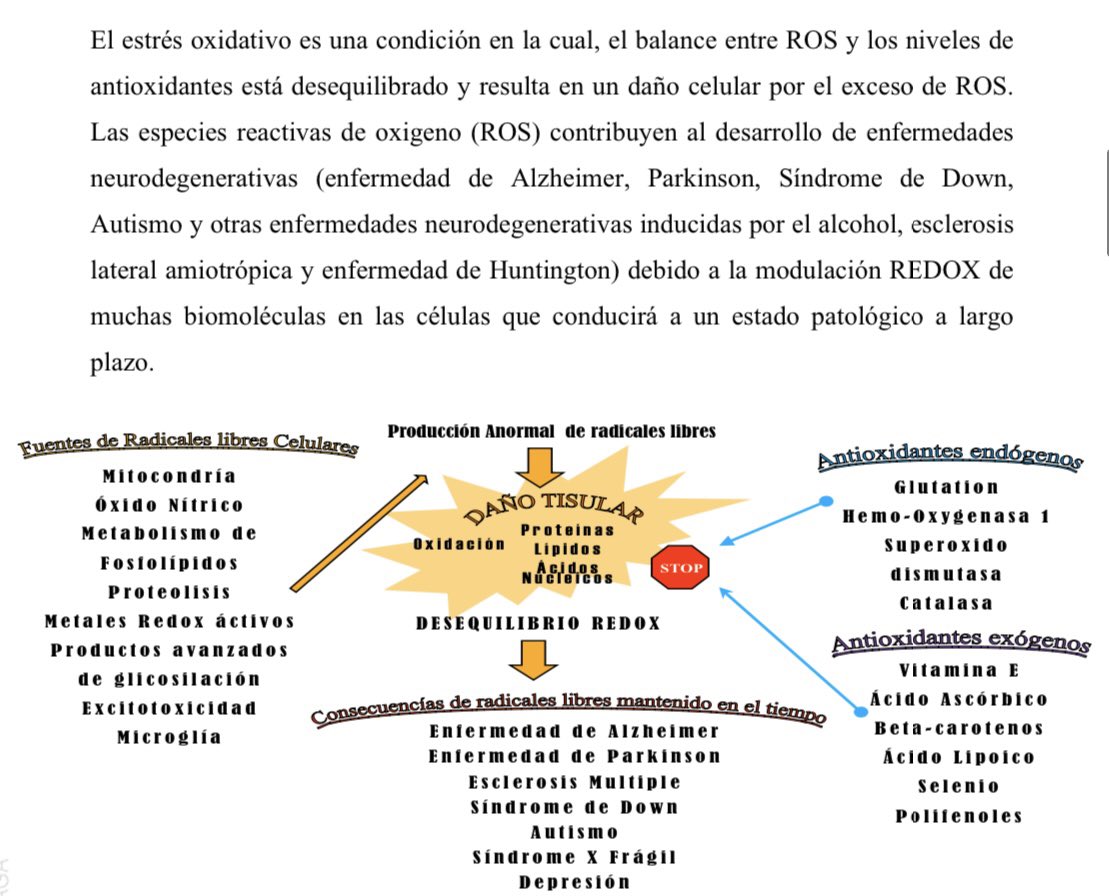
En consecuencia, también FMR1 tiene influencia en el estrés oxidativo y la toxicidad celular. Un equipo de investigadores con tecnología CRISPR-Cas9 han podido observar los efectos de suprimir/aumentar esta frataxina. https://fedaes.org/los-niveles-demasiado-altos-de-frataxina-pueden-causar-estres-y-toxicidad-celular/">https://fedaes.org/los-nivel...
Este gen FMR1 está localizado en el cromosoma X  https://abs.twimg.com/emoji/v2/... draggable="false" alt="🤔" title="Denkendes Gesicht" aria-label="Emoji: Denkendes Gesicht"> y mutaciones de este gen producen daño oxidativo y radicales libres que se producen el síndrome de x frágil, desaprendizaje, pérdida de memoria, fracaso ovárico prematuro, autismo, Parkinson, Alzheimer... https://riuma.uma.es/xmlui/handle/10630/12774">https://riuma.uma.es/xmlui/han...
https://abs.twimg.com/emoji/v2/... draggable="false" alt="🤔" title="Denkendes Gesicht" aria-label="Emoji: Denkendes Gesicht"> y mutaciones de este gen producen daño oxidativo y radicales libres que se producen el síndrome de x frágil, desaprendizaje, pérdida de memoria, fracaso ovárico prematuro, autismo, Parkinson, Alzheimer... https://riuma.uma.es/xmlui/handle/10630/12774">https://riuma.uma.es/xmlui/han...
Entonces siguiendo los ensayos con este interesante FMR1, vemos que para probar esa respuesta se utilizan otros organismos como Drosophila melanogaster, ratón Mus musculus y cómo no, también el Rattus norvegicus huésped original en SARs-CoV-2. ¿Para qué tipo de procesos se usan?
Pues para entender enfermedades como Alzheimer o Ataxia de Friedrich, que son neurodegenerativas y en las que estaría involucrada la deficiencia del hierro que produce daño oxidativo y conlleva muerte celular. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2605773/">https://www.ncbi.nlm.nih.gov/pmc/artic...
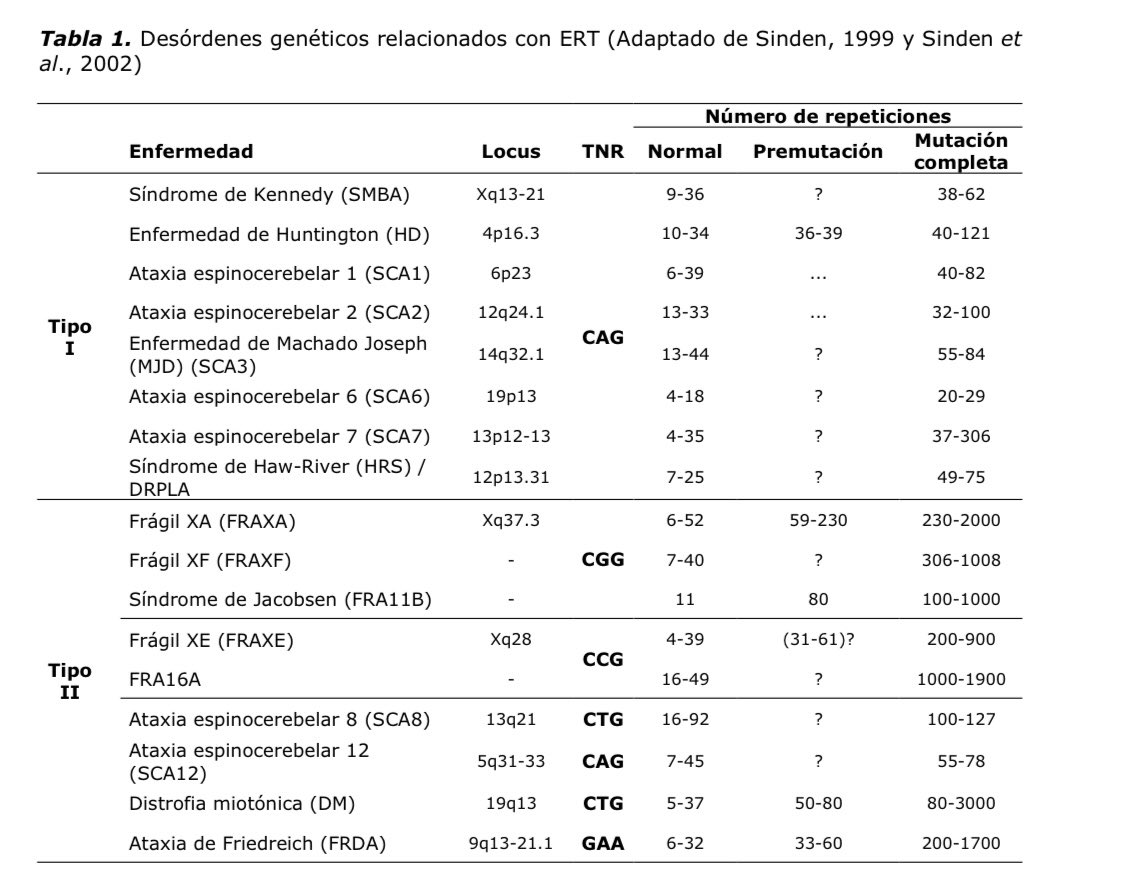
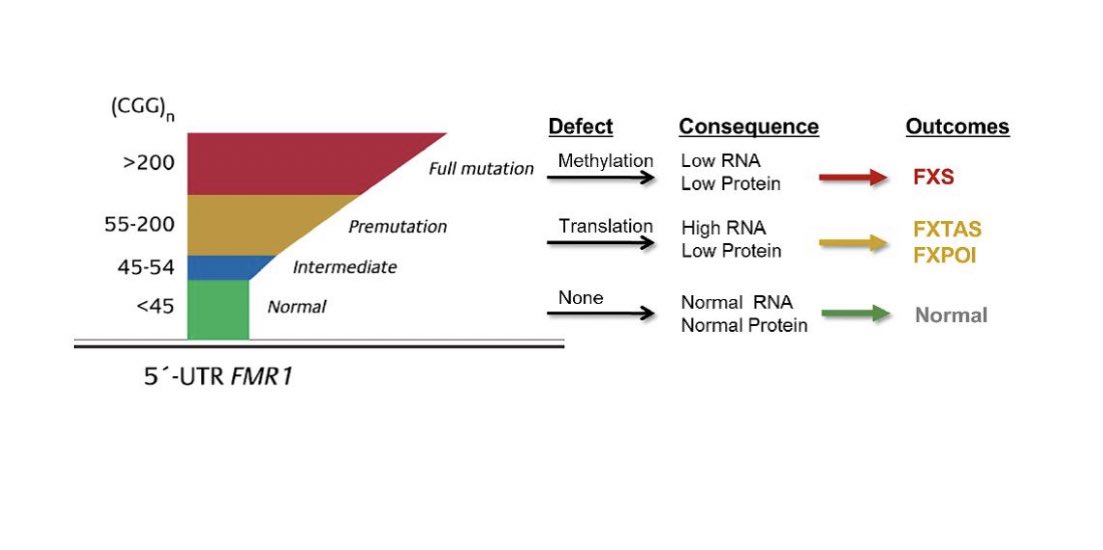
Entre estas enfermedades también está el Síndrome X frágil. Este síndrome se caracteriza genéticamente por un detalle muy especial. Se detecta en los individuos que lo poseen por el aumento del número de repeticiones del triplete citosina (C)- Guanina (G)- Guanina (G): CGG!!
El gen responsable de estas repeticiones es el FMR1. El nº de mutaciones varía pero puede sobrepasar las 200. Se ha observado en ratones que si sobrepasa 200 este gen se silencia. Si se silencia ¡no se traduce al ARN! (La R?) https://abs.twimg.com/emoji/v2/... draggable="false" alt="🤔" title="Denkendes Gesicht" aria-label="Emoji: Denkendes Gesicht">
https://abs.twimg.com/emoji/v2/... draggable="false" alt="🤔" title="Denkendes Gesicht" aria-label="Emoji: Denkendes Gesicht">
Dejo estudio (de pago https://abs.twimg.com/emoji/v2/... draggable="false" alt="😔" title="Nachdenkliches Gesicht" aria-label="Emoji: Nachdenkliches Gesicht">) https://www.elsevier.es/es-revista-medicina-clinica-2-articulo-expansion-del-triplete-citosina-guanina-guanina-3-S002577531500648X">https://www.elsevier.es/es-revist...
https://abs.twimg.com/emoji/v2/... draggable="false" alt="😔" title="Nachdenkliches Gesicht" aria-label="Emoji: Nachdenkliches Gesicht">) https://www.elsevier.es/es-revista-medicina-clinica-2-articulo-expansion-del-triplete-citosina-guanina-guanina-3-S002577531500648X">https://www.elsevier.es/es-revist...
Dejo estudio (de pago
No solo eso, también existen estudios que ponen en relación el bajo número de tripletes ¡con el estrés!! considerando que este gen queda influido por el ambiente. Os dejo estudio muy interesante de lo que puede implicar tener pocos CGG en nuestro genoma. https://www.rafer.es/innovacion-laboratorio-clinico/efectos-bajo-numero-de-repeticiones-cgg-en-gen-fmr1/">https://www.rafer.es/innovacio...
Esto me llevó a investigar si se habían realizado pruebas en animales de laboratorio para estudiar estos codones de repetición. Y el documento aportado por @BidoliNicola  https://abs.twimg.com/emoji/v2/... draggable="false" alt="🤗" title="Umarmendes Gesicht" aria-label="Emoji: Umarmendes Gesicht"> ayudó a poner en relación a Zeng-Li con experimentos con anticuerpos de conejo. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6178078/#!po=63.4615">https://www.ncbi.nlm.nih.gov/pmc/artic...
https://abs.twimg.com/emoji/v2/... draggable="false" alt="🤗" title="Umarmendes Gesicht" aria-label="Emoji: Umarmendes Gesicht"> ayudó a poner en relación a Zeng-Li con experimentos con anticuerpos de conejo. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6178078/#!po=63.4615">https://www.ncbi.nlm.nih.gov/pmc/artic...

 Read on Twitter
Read on Twitter " title="¡OTRA PIEZA MÁS! CGGLevadura Saccharomyces cerevisiaeDrosophila melanogasterFrataxinaAcumulación de hierroToxicidad celularSíndrome X frágil Ratones transgénicos Mus musculus/Rattus norvegicus¿Qué sucede si los ponemos a todos en relación?¿EXPLICAMOS CGGCGG?https://abs.twimg.com/emoji/v2/... draggable="false" alt="👇" title="Rückhand Zeigefinger nach unten" aria-label="Emoji: Rückhand Zeigefinger nach unten">" class="img-responsive" style="max-width:100%;"/>
" title="¡OTRA PIEZA MÁS! CGGLevadura Saccharomyces cerevisiaeDrosophila melanogasterFrataxinaAcumulación de hierroToxicidad celularSíndrome X frágil Ratones transgénicos Mus musculus/Rattus norvegicus¿Qué sucede si los ponemos a todos en relación?¿EXPLICAMOS CGGCGG?https://abs.twimg.com/emoji/v2/... draggable="false" alt="👇" title="Rückhand Zeigefinger nach unten" aria-label="Emoji: Rückhand Zeigefinger nach unten">" class="img-responsive" style="max-width:100%;"/>
 y mutaciones de este gen producen daño oxidativo y radicales libres que se producen el síndrome de x frágil, desaprendizaje, pérdida de memoria, fracaso ovárico prematuro, autismo, Parkinson, Alzheimer... https://riuma.uma.es/xmlui/han..." title="Este gen FMR1 está localizado en el cromosoma X https://abs.twimg.com/emoji/v2/... draggable="false" alt="🤔" title="Denkendes Gesicht" aria-label="Emoji: Denkendes Gesicht"> y mutaciones de este gen producen daño oxidativo y radicales libres que se producen el síndrome de x frágil, desaprendizaje, pérdida de memoria, fracaso ovárico prematuro, autismo, Parkinson, Alzheimer... https://riuma.uma.es/xmlui/han..." class="img-responsive" style="max-width:100%;"/>
y mutaciones de este gen producen daño oxidativo y radicales libres que se producen el síndrome de x frágil, desaprendizaje, pérdida de memoria, fracaso ovárico prematuro, autismo, Parkinson, Alzheimer... https://riuma.uma.es/xmlui/han..." title="Este gen FMR1 está localizado en el cromosoma X https://abs.twimg.com/emoji/v2/... draggable="false" alt="🤔" title="Denkendes Gesicht" aria-label="Emoji: Denkendes Gesicht"> y mutaciones de este gen producen daño oxidativo y radicales libres que se producen el síndrome de x frágil, desaprendizaje, pérdida de memoria, fracaso ovárico prematuro, autismo, Parkinson, Alzheimer... https://riuma.uma.es/xmlui/han..." class="img-responsive" style="max-width:100%;"/>
 Dejo estudio (de pago https://abs.twimg.com/emoji/v2/... draggable="false" alt="😔" title="Nachdenkliches Gesicht" aria-label="Emoji: Nachdenkliches Gesicht">) https://www.elsevier.es/es-revist..." title="El gen responsable de estas repeticiones es el FMR1. El nº de mutaciones varía pero puede sobrepasar las 200. Se ha observado en ratones que si sobrepasa 200 este gen se silencia. Si se silencia ¡no se traduce al ARN! (La R?)https://abs.twimg.com/emoji/v2/... draggable="false" alt="🤔" title="Denkendes Gesicht" aria-label="Emoji: Denkendes Gesicht">Dejo estudio (de pago https://abs.twimg.com/emoji/v2/... draggable="false" alt="😔" title="Nachdenkliches Gesicht" aria-label="Emoji: Nachdenkliches Gesicht">) https://www.elsevier.es/es-revist..." class="img-responsive" style="max-width:100%;"/>
Dejo estudio (de pago https://abs.twimg.com/emoji/v2/... draggable="false" alt="😔" title="Nachdenkliches Gesicht" aria-label="Emoji: Nachdenkliches Gesicht">) https://www.elsevier.es/es-revist..." title="El gen responsable de estas repeticiones es el FMR1. El nº de mutaciones varía pero puede sobrepasar las 200. Se ha observado en ratones que si sobrepasa 200 este gen se silencia. Si se silencia ¡no se traduce al ARN! (La R?)https://abs.twimg.com/emoji/v2/... draggable="false" alt="🤔" title="Denkendes Gesicht" aria-label="Emoji: Denkendes Gesicht">Dejo estudio (de pago https://abs.twimg.com/emoji/v2/... draggable="false" alt="😔" title="Nachdenkliches Gesicht" aria-label="Emoji: Nachdenkliches Gesicht">) https://www.elsevier.es/es-revist..." class="img-responsive" style="max-width:100%;"/>


