LOS PRIONES
¿Sabíais que hay algo más pequeño y simple que un virus, capaz de infectarnos? Las proteínas.
Abro hilo:
1. Érase una vez . . .
2. ¿Qué es un prion?
3. La proteína priónica. Replicación y Transmisión
4. Enfermedades priónicas
¿Sabíais que hay algo más pequeño y simple que un virus, capaz de infectarnos? Las proteínas.
Abro hilo:
1. Érase una vez . . .
2. ¿Qué es un prion?
3. La proteína priónica. Replicación y Transmisión
4. Enfermedades priónicas
1. ÉRASE UNA VEZ
La historia comienza en el siglo XVIII cuando ganaderos europeos observaron que sus ovejas empezaron a comportarse de forma extraña: se frotaban compulsivamente contra superficies, temblaban incontrolablemente, tenían alteraciones motrices y finalmente morían
La historia comienza en el siglo XVIII cuando ganaderos europeos observaron que sus ovejas empezaron a comportarse de forma extraña: se frotaban compulsivamente contra superficies, temblaban incontrolablemente, tenían alteraciones motrices y finalmente morían
1.1) La enfermedad fue bautizada como scrapie o tembladera, y algo que llamó la atención es que el cerebro de los animales afectados parecían esponja (espongiforme). Se creía que la enfermedad era a causa de la reproducción endogámica del ganado y por tanto de origen genético
1.2) Pero en el siglo XX se demostró que el scrapie era una enfermedad infecciosa al conseguir transmitirla experimentalmente a cabras. Aún así, no se había conseguido aislar ninguna bacteria o virus de los animales enfermos por lo que debía ser un patógeno totalmente nuevo
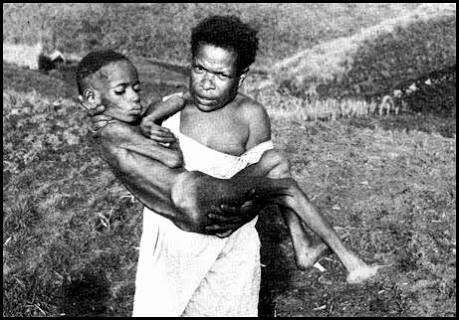
1.3) Nos trasladamos ahora de las granjas europeas a Papúa Nueva Guinea, dónde en el siglo XX el médico Vincent Zigas y el virólogo Carleton Gajdusek viajaron para estudiar una extraña enfermedad que afectaba a la tribu de aborígenes Fore y que ellos llamaban kuru
1.4) El kuru se trataba de una enfermedad neurodegenerativa y mortal El estudio del cerebro de víctimas de esta enfermedad arrojo cierta luz a su origen etiológico al encontrar similitudes con otra neuropatología descrita en Occidente, la enfermedad de Jakob y Creutzfeldt (EJC).
1.5) Tanto en enfermos por kuru y EJC se encontró un cerebro espongiforme (¿os acordáis de las ovejas?). Gajdusek demostró que el kuru era una enfermedad infecciosa al conseguir transmitirla experimentalmente a primates. Años más tardes se demostraba lo mismo para la EJC
1.6) Las evidencias apuntaban a que el kuru y la EJC estaban relacionadas entre si y con el scrapie. Las tres enfermedades se englobaron bajo el término Encefalopatías Espongiformes Transmisibles (EET)
¿Eran manifestaciones distintas de una misma neuropatología o diferentes?
¿Eran manifestaciones distintas de una misma neuropatología o diferentes?
1.7) Comenzaron así las pesquisas por encontrar el agente causante de aquellas enfermedades. Primero se descartaron los virus al no conseguir evitar la transmisión por el tratamiento con formaldehído de los macerados cerebrales que eran usados en los experimentos de transmisión
1.8) En segundo lugar los macerados cerebrales de animales enfermos fueron tratados con rayos UV y químicos que alteraban ADN y ARN, pero no se evitó la transmisión de la enfermedad a animales sanos. Conclusión: el agente patógeno era independiente de ácidos nucleicos
1.9) Hasta entonces los patógenos descubiertos dependían estrictamente de un material genético (ácidos nucleicos). Lo aún más extraño fue que el tratamiento con proteasas(degradan proteínas) de los macerados cerebrales si que conseguía reducir la infectividad
1.10) Nadie se atrevía a verbalizar lo que los hechos demostraban, hasta que en 1967 el químico y biofísico Griffith se tiró a la piscina y propuso nada y menos que la causa del scrapie era una proteína, y propuso tres teorías que explicaban cómo una proteína sería infecciosa
1.11) Aquello fue una herejía en contra del dogma sobre el se asentaba la biología molecular y la comunidad científica se separó entre partidarios y en contra. Años más tarde Prusiner demostraría que Griffith estaba en lo cierto y el dogma central recibiría un derechazo
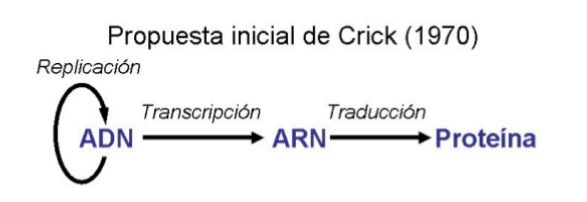
1.12) Ahora viene cuando os cuento sobre el dogma central de la biología molecular. Este dogma proponía que la transmisión y expresión de la información genética ocurre en una dirección. De ADN a ARN y de ARN a proteína. La dirección que a todos nos enseñaron en la escuela
1.13) Pues bien este dogma en un lapso de 10 años no recibió uno, ni dos, sino tres derechazos que dejaron a la comunidad científica y la naciente biología molecular muertas. El primero: el descubrimiento de la retrotranscriptasa inversa, se descubría que el ARN podía pasar a ADN
1.14) El segundo: el descubrimiento de las ribozimas, moléculas de ARN con actividad enzimática (función que hasta entonces se reservaba a proteínas). Y el tercero y último del que yo he venido a hablar: los priones
2. ¿QUÉ ES UN PRION?
Un prion es una proteína con una conformación/estructura aberrante que es capaz de transmitir dicha conformación aberrante a proteínas iguales y de esa manera perpetuarse sin necesidad de un material genético
Un prion es una proteína con una conformación/estructura aberrante que es capaz de transmitir dicha conformación aberrante a proteínas iguales y de esa manera perpetuarse sin necesidad de un material genético
2.1) Lo loco de los priones es que hasta su descubrimiento las proteínas se definían por recibir su información del ADN, no se había visto que una proteína transmitiera a otra una información y replicarse sin necesidad de ADN (la info que se transmite es la estructura aberrante)
2.2) Es como si al poner en contacto una botella de plástico deformada con otra en perfecto estado, esta segunda se deformara sin la acción de fuerzas externas. No tendría lógica, ¿verdad? Pues así estaba la comunidad científica cuando los priones fueron descritos por primera vez
2.3) El término prion fue acuñado en 1982 por Prusiner y deriva del inglés PRotein and InfectiON. Prusiner y sus colabs aislaron la proteína causante del scrapie y consiguieron replicar la enfermedad con ella. Aquella proteína era la proteína priónica o PrP.
3) LA PROTEÍNA PRIÓNICA. REPLICACIÓN Y TRANSMISIÓN
La proteína priónica o PrP es una proteína que todos nosotros tenemos matoritariamente a nivel neuronal ¿cómo?¿entonces todos nosotros estamos infectados y tendremos una Encefalopatía Espongiforme?
No ¡Que no cunda el pánico!
La proteína priónica o PrP es una proteína que todos nosotros tenemos matoritariamente a nivel neuronal ¿cómo?¿entonces todos nosotros estamos infectados y tendremos una Encefalopatía Espongiforme?
No ¡Que no cunda el pánico!
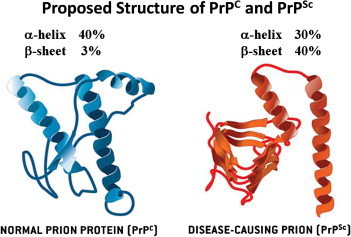
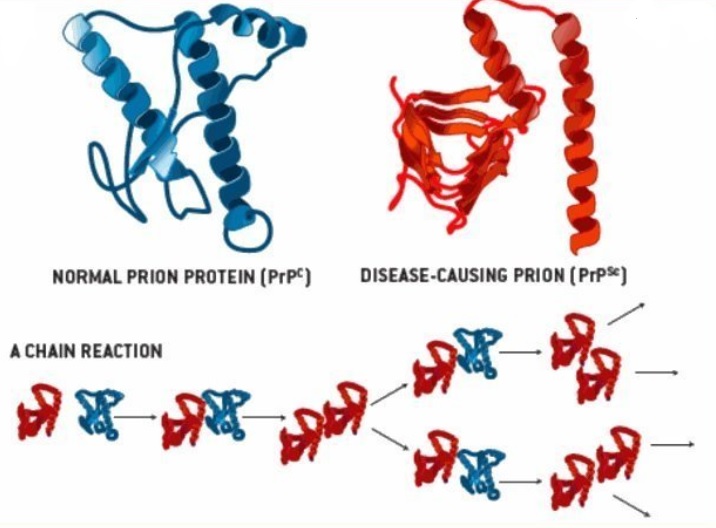
3.1) La proteína PrP se encuentra en dos formas: no patogénica (PrP-c) y patogénica (PrP-sc). Siendo la última la causante de las Encefalopatías Espongiformes Transmisibles (EET). La diferencia entre una forma y otra es su estructura. Lo siento pero toca entrar un poco en materia
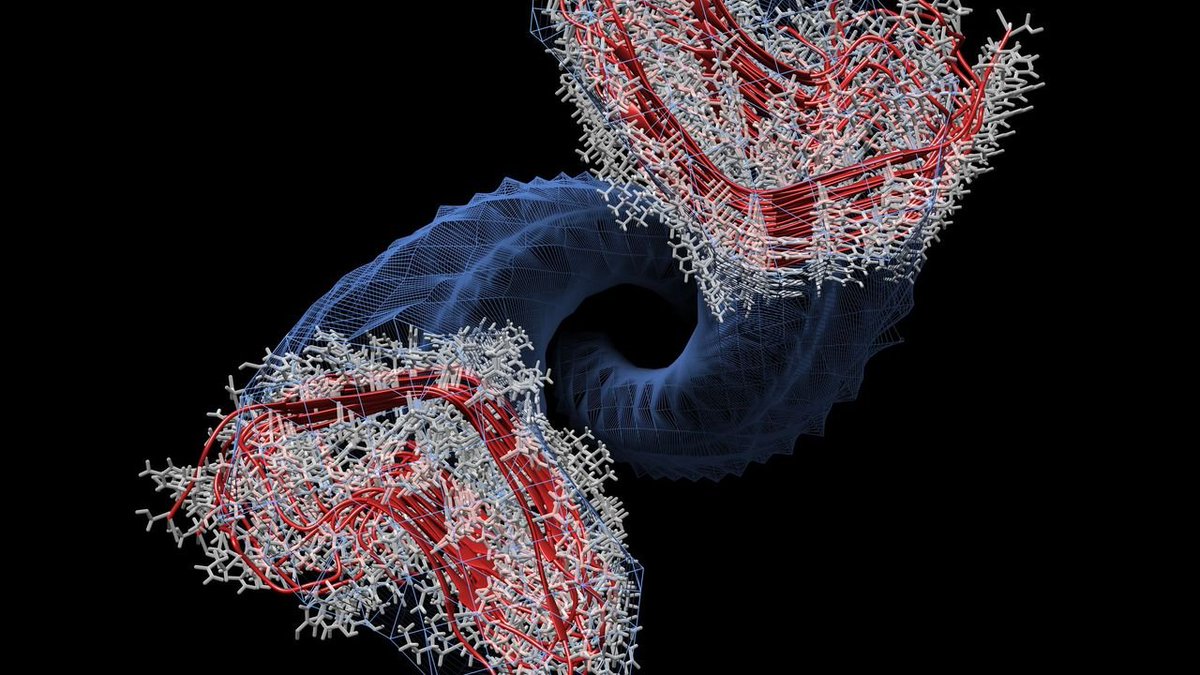
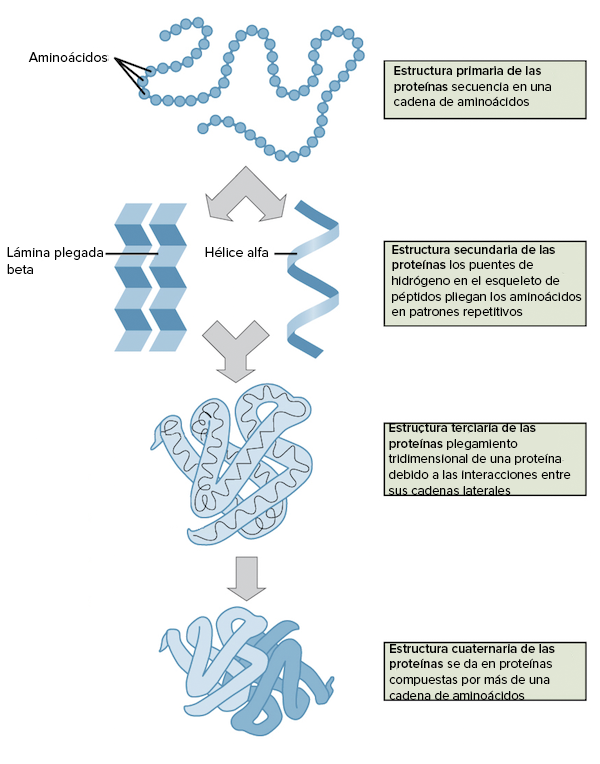
3.2) Cuando hablamos de estructura de proteínas hablamos de la disposición espacial que ocupan sus aminoácidos. La estructura de proteínas tiene entre 3-4 niveles y el proceso por le cuál se pasa del primero al último nivel se llama plegamiento
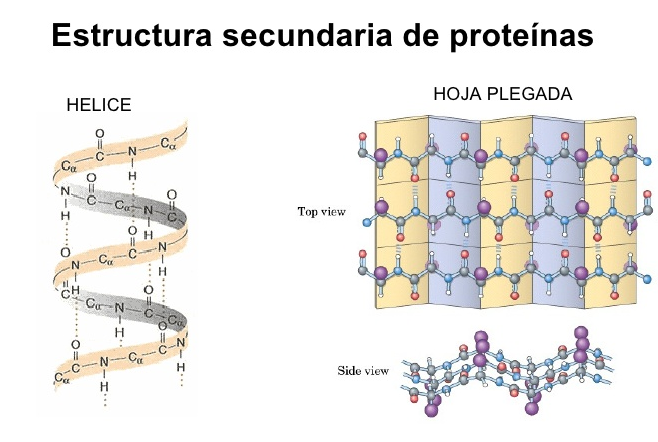
3.3) La estructura primeria es tan simple como la secuencia de aminoácidos. Luego estos aminoácidos pueden interaccionar entre sí por enlaces químicos y adquirir una estructura secundaria que puede resumirse en dos: hélices alfa o láminas beta
3.4) Pues bien, la forma natural y funcional de la PrP (la PrP-c, que es la que todos tenemos) se compone de un 47% de hélices alfa y 3% de láminas beta, mientras que la forma PrP-sc se compone de 17-30% de hélices alfa y 43-54% de láminas beta. ¿Y qué implicaciones tiene esto?
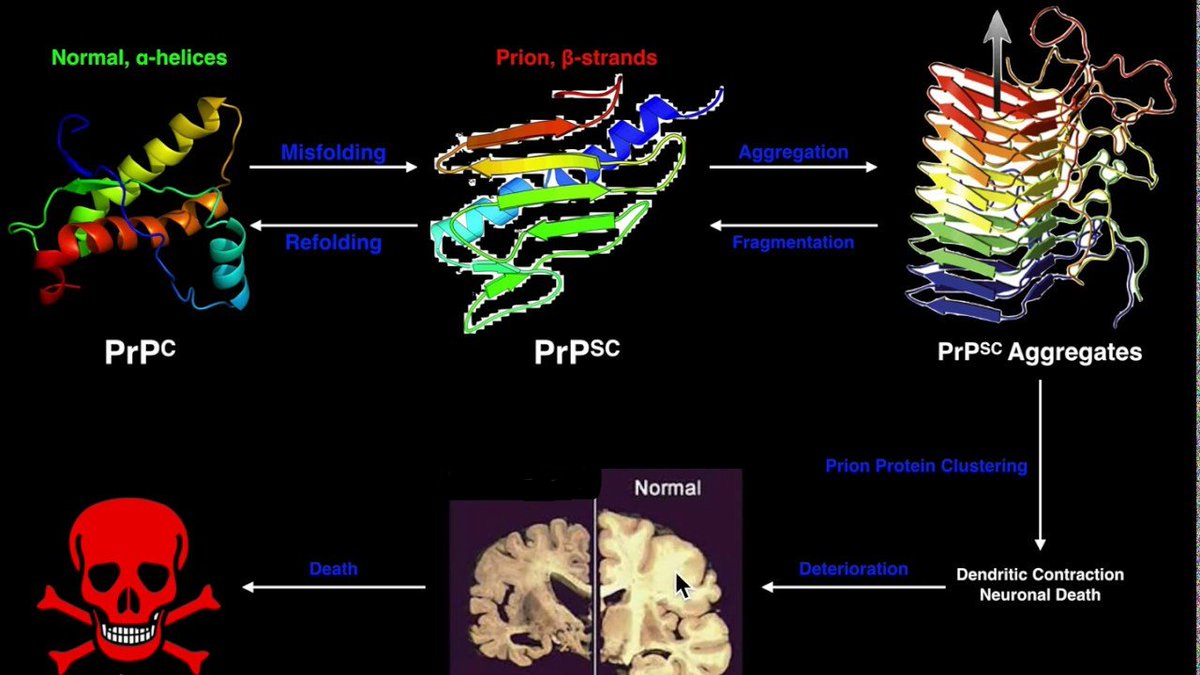
3.5) Pues que la estructura secundaria de la PrP-sc le permite adquirir una estructura terciaria resistente a los procesos celulares de degradación de proteínas que intervienen cuando una proteína está mal plegada. Además se vuelve insoluble y capaz de formar agregados proteicos
3.6) Estos agregados proteicos acaban siendo neurotóxicos produciendo la muerte progresiva de las neuronas con el consiguiente deterioro cerebral que encontramos en las Encefalopatías Espongiformes Transmisibles (EET)
Quizás os estéis preguntado, ¿pero cómo se forma la PrP-sc?
Quizás os estéis preguntado, ¿pero cómo se forma la PrP-sc?
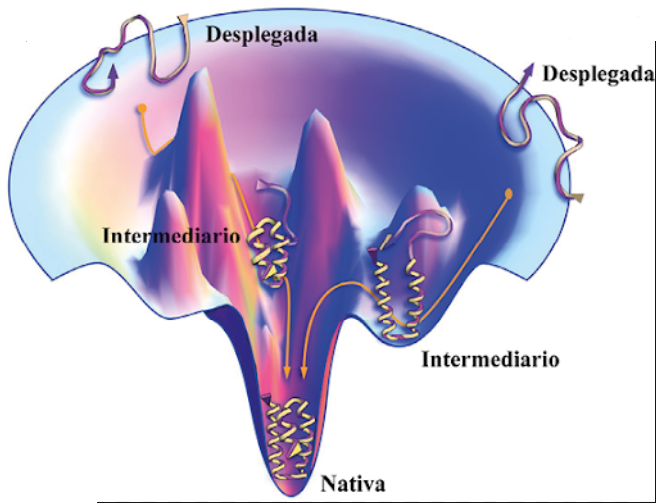
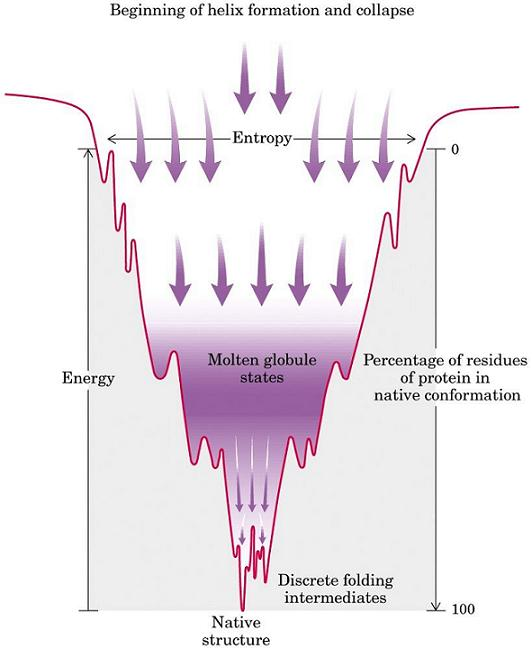
3.7) La forma PrP-sc surge azarosamente durante el proceso de plegamiento de la proteína natural y es que el plegamiento de un proteína es complejo y puede estar lleno de errores. El plegamiento de una proteína se explica por la teoría del embudo (imagen descriptiva abajo)
3.8) Una proteína comienza a plegarse espacialmente hasta alcanzar la estructura nativa o estructura termodinámicamente más estable. Durante el proceso se pueden alcanzar estados intermediarios no definitivos que podrían pasar a un estado estable y diferente al nativo
3.9) Algo así estaría pasando con la PrP-c. Por alguna razón desconocida y poco problable (la incidencia de las EET es baja) se alcanza un estado energético PrP-c* que acaba por derivar en la forma PrP-sc que es termodinámicamente más óptima que la conformación nativa natural
3.10) Las formas PrP-sc terminan por agregarse y formar complejos de nucleación o oligomerización que inician una reacción en cadena por la que al interaccionar con otras PrP-c las transforman a PrP-sc y de esa forma se replica. O al menos esa es una de las teorías más aceptada
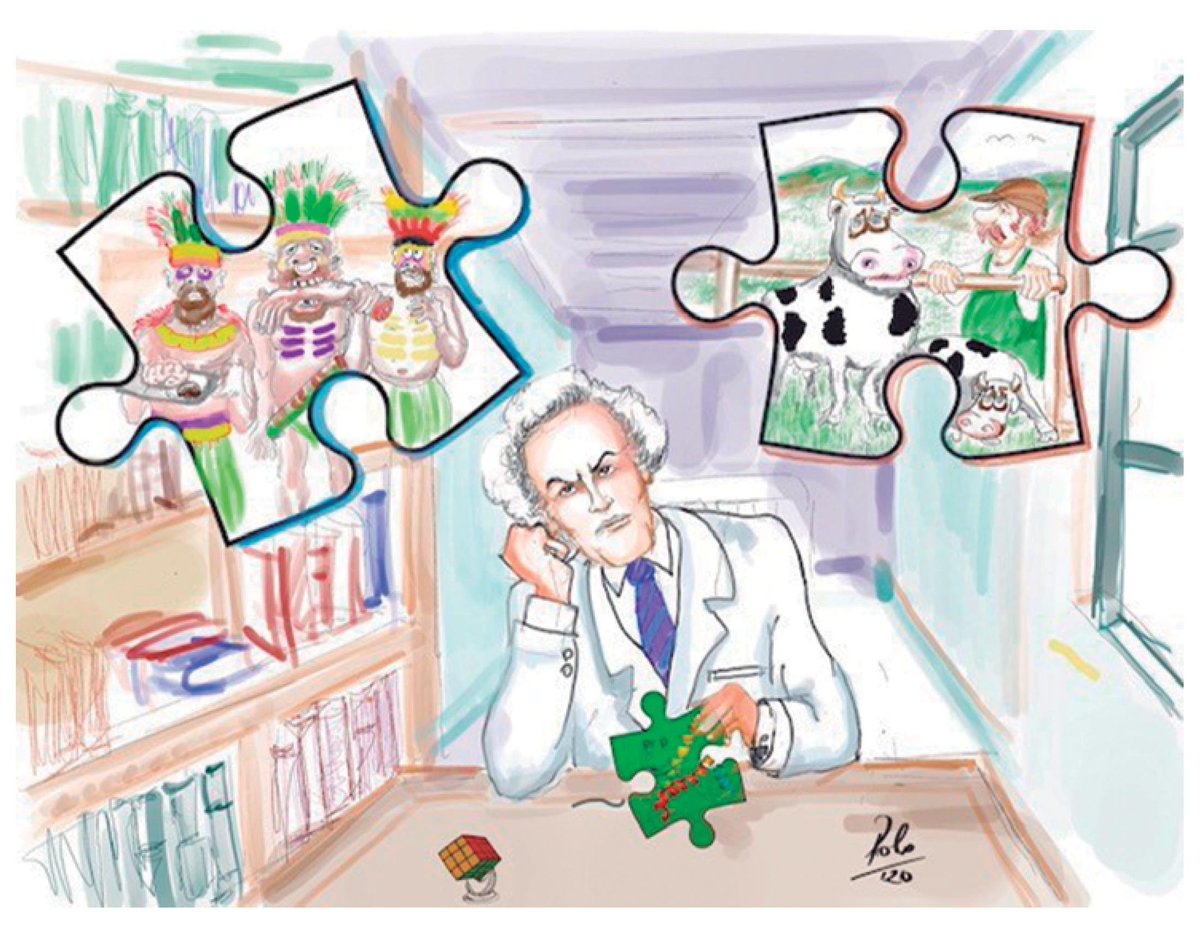
3.11) La capacidad de la PrP-sc de transmitir la estructura aberrante a una PrP-c dependerá de la similitud en la secuencia de aminoácidos de ambas proteínas. O dicho de otra forma, la transmisión será más fácil entre individuos de una misma especie y dentro de un mismo individuo
3.12) A esto se le paso a llamar "la barrera entre especies". De forma que la forma PrP-sc surgía esporádicamente en un individuo de una especie y luego era transmitida al resto al entrar en contacto la PrP-sc del enfermo con las formas PrP-c de individuos sanos
3.13) En los individuos sanos las PrP-sc transmitidas se agregan, forman los centros de oligomerización y transforman las PrP-c en aberrantes y patogénicas, desarrollándose finalmente la enfermedad
¿Pero cómo entran en contacto si son proteínas cerebrales?
¿Pero cómo entran en contacto si son proteínas cerebrales?
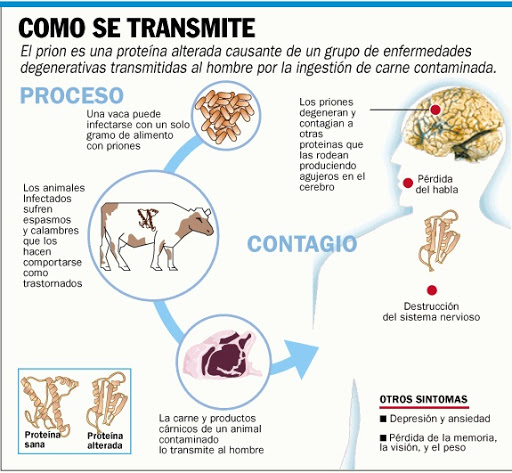
3.14) Pues a través de la ingesta de alimentos contaminados. Así es, la tribu Fore practicaba el canibalismo de sus parientes muertos como parte de sus ritos culturales. Y de esta forma se explica porque en esa tribu estaba ampliamente extendida el Kuru una enfermedad priónica
4) ENFERMEDADES PRIÓNICAS
También conocidas como Encefalopatías Espongiformes Transmisibles (EET). Se clasifican en tres según su origen: esporádicas, adquiridas y familiares. Pero me tomaré la licencia propia de incluir las adquiridas dentro de las esporádicas para simplificar
También conocidas como Encefalopatías Espongiformes Transmisibles (EET). Se clasifican en tres según su origen: esporádicas, adquiridas y familiares. Pero me tomaré la licencia propia de incluir las adquiridas dentro de las esporádicas para simplificar
4.1) Las EET esporádicas son aquellas que no tienen un componente genético asociado. Ya se que antes os he dicho que los priones se transmiten independientemente de ADN y ARN, pero no quiere decir que una proteína pueda existir sin ser antes sintetizada a partir de ADN
4.2) De esta forma, en las EET esporádicas no existen mutaciones en el gen de la PrP que la predispongan a dar la forma patogénica. Mientras que en las EET familiares el gen de la PrP presenta mutaciones que las predisponen a la forma patogénica
4.3) Las EET esporádicas/adquiridas surgen por lo explicado en el punto 3 de este hilo e incluye las siguientes enfermedades en humanos: la enfermedad de Jacob y Creutzfeldt (EJC), el kuru y la variante de la EJC (vEJC). Me voy a centrar en esta última de la que un no he hablado
4.4) La vEJC es una enfermedad priónica similar a la EJC pero con la diferencia de que ocurren en personas más jóvenes y presenta afecciones psiquiátricas. Las evidencias científicas apuntan a que esta variante de la EJC esta directamente relacional con el mal de las vacas locas
4.5) En 1986 se detectaba el primer caso de encefalopatía espongiforme bovina y en 1996 el primer caso de la vEJC que se relacionó con la epidemia de las vacas locas que hizo saltar todas las alarmas en la cadena agroalimentaria generando una gran crisis en el consumo de carne
4.6) Pero tranquilos los sistemas de agroseguridad se actualizaron para detectar los casos de encefalopatías espongiformes y evitar así el consumo del ganado enfermo y tras la epidemia del final del siglo XX, los casos de encefalopatía espongiformes bovinas han sido mínimos
4.7) Por último, las EET familiares incluyen las siguientes enfermedades: el síndrome de Gerstmann-Sträussler-Scheinker (GSS), formas familiares de la EJC y el insomnio familiar fatal. Voy a hablaros un poco de este último
4.8) El insomnio familiar fatal es una enfermedad priónica hereditaria muy rara que comienza a manifestarse con una desregulación del ciclo vigilia-sueño que acaba por degenerar en insomnio persistente y deterioro de la memoria y otras funciones biológicas en última instancia
4.9) A pesar de ser un enfermedad muy poco común curiosamente la mitad de todos los casos de esta enfermedad se agrupan en dos comunidades de España: País Vasco y Navarra, dónde existe una mayor prevalencia del gen mutado por agregación familiar
4.10) Por último, no existe tratamiento para las Encefalopatías Espongiformes Transmisibles. Son enfermedades progresivas y mortales. A día de hoy los únicos tratamientos son de tipo paliativo y cuidado de la persona enferma

 Read on Twitter
Read on Twitter