À moins d’être confiné dans une grotte, vous avez tous entendu parler de chloroquine, des études de Raoult, d’essai randomisé, et de double aveugle  https://abs.twimg.com/emoji/v2/... draggable="false" alt="🧐" title="Face with monocle" aria-label="Emoji: Face with monocle">
https://abs.twimg.com/emoji/v2/... draggable="false" alt="🧐" title="Face with monocle" aria-label="Emoji: Face with monocle">
Si vous n’y voyez pas clair dans tout ça, j’ai essayé de remettre les choses dans l’ordre, avec un peu de recul.
#Thread https://abs.twimg.com/emoji/v2/... draggable="false" alt="⬇️" title="Downwards arrow" aria-label="Emoji: Downwards arrow">
https://abs.twimg.com/emoji/v2/... draggable="false" alt="⬇️" title="Downwards arrow" aria-label="Emoji: Downwards arrow"> https://abs.twimg.com/emoji/v2/... draggable="false" alt="⬇️" title="Downwards arrow" aria-label="Emoji: Downwards arrow">
https://abs.twimg.com/emoji/v2/... draggable="false" alt="⬇️" title="Downwards arrow" aria-label="Emoji: Downwards arrow">
Si vous n’y voyez pas clair dans tout ça, j’ai essayé de remettre les choses dans l’ordre, avec un peu de recul.
#Thread
On commence avec cette étude d’une équipe chinoise https://academic.oup.com/jac/advance-article/doi/10.1093/jac/dkaa114/5810487">https://academic.oup.com/jac/advan... qui explique que d’après eux, 2 médicaments sont prometteurs pour le covid-19 :
- le remdesivir, antiviral développé pour Ebola
- la chloroquine, utilisée contre le paludisme et des maladies auto-immunes
- le remdesivir, antiviral développé pour Ebola
- la chloroquine, utilisée contre le paludisme et des maladies auto-immunes
Ils préconisent aussi d’utiliser l’hydroxychloroquine (molécule de droite) plutôt que la chloroquine (à gauche), car sa toxicité est plus faible et la dose administrée peut être plus importante, ce qui en renforce l’effet.
Les deux ont toutefois des effets secondaires pouvant entraîner des complications cardiaques qui peuvent être très sévères.
Chez ceux qui ont eu ces complications, 30% sont décédés, et moins de la moitié ont vu leur état s’améliorer.
https://link.springer.com/article/10.1007/s40264-018-0689-4">https://link.springer.com/article/1...
Chez ceux qui ont eu ces complications, 30% sont décédés, et moins de la moitié ont vu leur état s’améliorer.
https://link.springer.com/article/10.1007/s40264-018-0689-4">https://link.springer.com/article/1...
Heureusement ce sont des complications très rares, sur les 20 dernières années seuls ~70 cas ont été rapportés dans la littérature, et pour eux la durée du traitement à la chloroquine était longue (7-8 ans) et la dose cumulée très importante (800-1200g).
On est donc très loin de la dizaine de jours de traitement qui est envisagée pour le covid-19 avec une dose totale d’une dizaine de grammes, ce qui limite grandement ce risque si les contre-indications sont respectées.
Bien.
Maintenant, et comme n’importe quel nouveau traitement, il y a 2 questions fondamentales qui se posent et qui vont guider le reste du thread :
1- est-ce qu’il est réellement efficace sur des malades ?
2- est-ce qu’il fait plus de bien que de mal ? (balance bénéfique risque)
Maintenant, et comme n’importe quel nouveau traitement, il y a 2 questions fondamentales qui se posent et qui vont guider le reste du thread :
1- est-ce qu’il est réellement efficace sur des malades ?
2- est-ce qu’il fait plus de bien que de mal ? (balance bénéfique risque)
Pour y répondre précisément, ces deux questions impliquent qu’il va falloir comparer des patients qui ont pris le traitement avec d’autres qui n’en n’ont pas pris.
« Quoi me dites-vous ? Mais c’est une perte de chance scandaleuse pour les patients qui n’auront pas le traitement !  https://abs.twimg.com/emoji/v2/... draggable="false" alt="😠" title="Angry face" aria-label="Emoji: Angry face"> »
https://abs.twimg.com/emoji/v2/... draggable="false" alt="😠" title="Angry face" aria-label="Emoji: Angry face"> »
Bah pas forcément en fait, regardez plutôt ce qui suit.
Bah pas forcément en fait, regardez plutôt ce qui suit.
Car si la chloroquine n’a que peu d’effets secondaires en elle-même, le risque est plutôt lié aux interactions qu’elle peut avoir avec la maladie et le malade, et il est très difficile voire impossible de le prévoir à l’avance.
Exemple, à La Réunion lors de l’épidémie de Chikungunya en 2005-2006, la chloroquine a été utilisée pour traiter le virus, car elle avait eu de bons résultats en laboratoire (essai in vitro).
Lorsqu’elle a été administrée à des vrais malades (essai in vivo), non seulement la chloroquine n’a montré aucune amélioration, mais en plus elle a entraîné des complications chroniques plus fréquentes que chez ceux qui n’avaient pas reçu le traitement...! https://www.mdpi.com/1999-4915/10/5/268/htm">https://www.mdpi.com/1999-4915...
Il est aussi important de noter que ces complications ont été identifiées entre 200 et 300 jours après la prise du traitement, d’où l’importance d’avoir un minimum de recul.
En définitive, c’étaient les patients sans traitement qui ont eu plus de chances.
En définitive, c’étaient les patients sans traitement qui ont eu plus de chances.
Dans le même genre, voici un autre exemple d’un essai où, avec un médicament à l’efficacité non prouvée, ceux qui ont eu le plus de chance était ceux sans traitement ou avec un placebo : https://twitter.com/fzores/status/1243459929618423808?s=21">https://twitter.com/fzores/st...
Ça met en lumière que ce n’est pas parce qu’un médicament est largement utilisé pour soigner certaines pathologies "depuis 70 ans" qu’on peut l’utiliser les yeux fermés pour en soigner d’autres, surtout lorsqu’elles sont nouvelles comme le covid-19.
https://academic.oup.com/cid/advance-article/doi/10.1093/cid/ciaa321/5811416">https://academic.oup.com/cid/advan...
https://academic.oup.com/cid/advance-article/doi/10.1093/cid/ciaa321/5811416">https://academic.oup.com/cid/advan...
Un essai clinique comparatif (appelé "essai clinique contrôlé") est en fait la seule manière de s’assurer que le remède est efficace et ne va pas aggraver encore plus la situation.
Parfait, go alors ! https://abs.twimg.com/emoji/v2/... draggable="false" alt="👏" title="Clapping hands sign" aria-label="Emoji: Clapping hands sign">
https://abs.twimg.com/emoji/v2/... draggable="false" alt="👏" title="Clapping hands sign" aria-label="Emoji: Clapping hands sign">
Euh... mais en fait comment on fait un essai clinique contrôlé ? https://abs.twimg.com/emoji/v2/... draggable="false" alt="🤨" title="Face with raised eyebrow" aria-label="Emoji: Face with raised eyebrow">
https://abs.twimg.com/emoji/v2/... draggable="false" alt="🤨" title="Face with raised eyebrow" aria-label="Emoji: Face with raised eyebrow">
Parfait, go alors !
Euh... mais en fait comment on fait un essai clinique contrôlé ?
Idéalement il faut inclure le plus de patients possible pour éviter des incertitudes trop importantes qui n’apporteraient aucun résultat fiable.
Et plus l’effet à détecter est faible, plus il faut de monde pour qu’il ressorte sans ambiguïté.
Et plus l’effet à détecter est faible, plus il faut de monde pour qu’il ressorte sans ambiguïté.
Pour comparer correctement le groupe avec le traitement du groupe sans traitement (appelé "groupe contrôle"), il faut s’assurer que la seule différence entre les deux groupes soit la prise du traitement.
Tout le reste doit être identique : répartition des âges, des sexes, prise en charge et soins, état de la maladie, antécédents médicaux, ...
C’est bien sûr impossible que tout soit identique, mais c’est ce vers quoi il faut tendre pour que l’étude soit la plus fiable possible.
C’est bien sûr impossible que tout soit identique, mais c’est ce vers quoi il faut tendre pour que l’étude soit la plus fiable possible.
Pour être complet il faut aussi un "groupe placebo" (qui peut selon les cas remplacer le groupe contrôle).
Les patients de ce groupe reçoivent un traitement similaire au vrai mais qui ne contient aucun principe actif. https://sciencepop.fr/2017/09/19/effet-placebo/">https://sciencepop.fr/2017/09/1...
Les patients de ce groupe reçoivent un traitement similaire au vrai mais qui ne contient aucun principe actif. https://sciencepop.fr/2017/09/19/effet-placebo/">https://sciencepop.fr/2017/09/1...
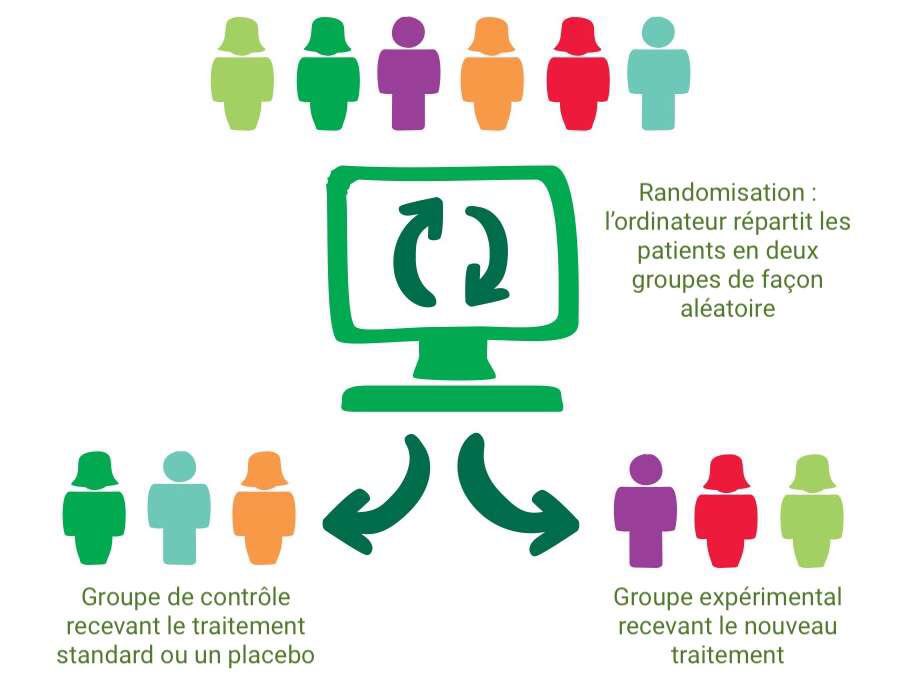
Une fois les patients enrôlés, comment on les répartit dans ces groupes ?
Comment décide-t-on qui va recevoir le traitement ?
Pour éviter tout biais conscient ou inconscient, la répartition des patients doit être faite de manière aléatoire : on parle alors d’étude "randomisée".
Comment décide-t-on qui va recevoir le traitement ?
Pour éviter tout biais conscient ou inconscient, la répartition des patients doit être faite de manière aléatoire : on parle alors d’étude "randomisée".
(parenthèse pour préciser que je dis enrôlé car c’est une traduction brute de l’anglais "enrolled", mais dans la réalité ce n’est pas du tout un enrôlement de force, c’est une proposition et le patient doit donner son consentement éclairé pour participer à l’essai)
Une fois les patients répartis, on déroule l’essai.
Pour éviter là aussi des biais, le mieux est que le soignant ne sache pas quel traitement il donne https://abs.twimg.com/emoji/v2/... draggable="false" alt="🙈" title="See-no-evil monkey" aria-label="Emoji: See-no-evil monkey">, et que le patient ne sache pas quel traitement il reçoit
https://abs.twimg.com/emoji/v2/... draggable="false" alt="🙈" title="See-no-evil monkey" aria-label="Emoji: See-no-evil monkey">, et que le patient ne sache pas quel traitement il reçoit  https://abs.twimg.com/emoji/v2/... draggable="false" alt="🙈" title="See-no-evil monkey" aria-label="Emoji: See-no-evil monkey">
https://abs.twimg.com/emoji/v2/... draggable="false" alt="🙈" title="See-no-evil monkey" aria-label="Emoji: See-no-evil monkey">
On parle alors d’étude en "double aveugle" https://abs.twimg.com/emoji/v2/... draggable="false" alt="🙈" title="See-no-evil monkey" aria-label="Emoji: See-no-evil monkey">
https://abs.twimg.com/emoji/v2/... draggable="false" alt="🙈" title="See-no-evil monkey" aria-label="Emoji: See-no-evil monkey"> https://abs.twimg.com/emoji/v2/... draggable="false" alt="🙈" title="See-no-evil monkey" aria-label="Emoji: See-no-evil monkey">
https://abs.twimg.com/emoji/v2/... draggable="false" alt="🙈" title="See-no-evil monkey" aria-label="Emoji: See-no-evil monkey">
Pour éviter là aussi des biais, le mieux est que le soignant ne sache pas quel traitement il donne
On parle alors d’étude en "double aveugle"
Voila, vous savez maintenant ce qu’est un essai clinique contrôlé randomisé en double aveugle  https://abs.twimg.com/emoji/v2/... draggable="false" alt="😎" title="Smiling face with sunglasses" aria-label="Emoji: Smiling face with sunglasses">
https://abs.twimg.com/emoji/v2/... draggable="false" alt="😎" title="Smiling face with sunglasses" aria-label="Emoji: Smiling face with sunglasses">
En réalité c’est bien sûr plus compliqué, et il y a quelques variantes (voir ici https://www.eupati.eu/fr/developpement-et-essais-cliniques/methodologies-des-essais-cliniques/)">https://www.eupati.eu/fr/develo... mais l’essentiel est là, et si vous avez compris c’est top https://abs.twimg.com/emoji/v2/... draggable="false" alt="😊" title="Smiling face with smiling eyes" aria-label="Emoji: Smiling face with smiling eyes">
https://abs.twimg.com/emoji/v2/... draggable="false" alt="😊" title="Smiling face with smiling eyes" aria-label="Emoji: Smiling face with smiling eyes"> https://abs.twimg.com/emoji/v2/... draggable="false" alt="👍" title="Thumbs up" aria-label="Emoji: Thumbs up">
https://abs.twimg.com/emoji/v2/... draggable="false" alt="👍" title="Thumbs up" aria-label="Emoji: Thumbs up">
En réalité c’est bien sûr plus compliqué, et il y a quelques variantes (voir ici https://www.eupati.eu/fr/developpement-et-essais-cliniques/methodologies-des-essais-cliniques/)">https://www.eupati.eu/fr/develo... mais l’essentiel est là, et si vous avez compris c’est top
Les essais cliniques contrôlés randomisés en double aveugle, et d’autant plus s’ils sont effectués avec de nombreux patients, sont la meilleure manière de prouver de façon précise l’efficacité (ou l’inefficacité) et les effets indésirables de traitements.
Le premier traitement à avoir bénéficié de cette méthode a été la streptomycine, antibiotique contre la tuberculose pulmonaire en 1948, et qui a valu le prix Nobel à son professeur.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1114161/pdf/1217.pdf">https://www.ncbi.nlm.nih.gov/pmc/artic...
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1114161/pdf/1217.pdf">https://www.ncbi.nlm.nih.gov/pmc/artic...
Avant ces études, chaque médecin administrait les traitements qu’il souhaitait, avec une évaluation toute relative de l’efficacité, qui était du coup forcément approximative.
Les progrès depuis cette époque ont été colossaux, grâce notamment aux essais cliniques contrôlés.
Les progrès depuis cette époque ont été colossaux, grâce notamment aux essais cliniques contrôlés.
« Mais on est en situation d’urgence on n’a pas le temps pour ça !  https://abs.twimg.com/emoji/v2/... draggable="false" alt="😠" title="Angry face" aria-label="Emoji: Angry face"> »
https://abs.twimg.com/emoji/v2/... draggable="false" alt="😠" title="Angry face" aria-label="Emoji: Angry face"> »
En fait c’est le cas pour toutes les maladies... elles sont toutes urgentes.
En fait c’est le cas pour toutes les maladies... elles sont toutes urgentes.
La tuberculose était à l’époque largement plus dangereuse que le covid-19, et pourtant, le temps pris pour réaliser l’essai clinique contrôlé et identifier le traitement correct a permis de sauver des millions de vies.
J’insiste car c’est hyper important : les études et les essais cliniques, ce ne sont pas juste de la paperasse méthodologique pour faire plaisir aux statisticiens et faire perdre du temps aux médecins, ce sont des piliers absolument fondamentaux de la médecine moderne.
Les dénigrer quelle que soit la raison, c’est remettre en cause plus d’un demi siècle de progrès et d’avancées médicales.
C’est une bonne transition avec les études de l’équipe de Raoult.
Il y en a 2 principales :
1- Celle où l’efficacité de son traitement est censée être démontrée
2- Celle avec plus de cas qui est censée confirmer la 1ère
Je vais juste résumer car ça a été déjà beaucoup discuté.
Il y en a 2 principales :
1- Celle où l’efficacité de son traitement est censée être démontrée
2- Celle avec plus de cas qui est censée confirmer la 1ère
Je vais juste résumer car ça a été déjà beaucoup discuté.
Pour la première : https://www.sciencedirect.com/science/article/pii/S0924857920300996
-">https://www.sciencedirect.com/science/a... Ils ont choisis quels patients allaient recevoir le traitement et lesquels ne l’auraient pas : biais
- Les patients et les soignants savaient qui avait le traitement et qui ne l’avait pas : biais
-">https://www.sciencedirect.com/science/a... Ils ont choisis quels patients allaient recevoir le traitement et lesquels ne l’auraient pas : biais
- Les patients et les soignants savaient qui avait le traitement et qui ne l’avait pas : biais
- Peu de patients étudiés (16 dans le groupe contrôle et 26 avec le traitement) : biais
- Parmi ces 26 traités, 6 ont arrêté l’essai (1 est mort, 3 en soin intensifs et 2 autres perdus de vue) mais n’ont pas été pris en compte dans le résultat : biais
- Parmi ces 26 traités, 6 ont arrêté l’essai (1 est mort, 3 en soin intensifs et 2 autres perdus de vue) mais n’ont pas été pris en compte dans le résultat : biais
- Leur seul critère de réussite est un indicateur biologique (charge virale dans la gorge), alors que ce qui compte vraiment est l’état du patient : biais
- Certains résultats sont manquants ou approximatifs (un jour positif le lendemain négatif) : biais
- Etc, etc...
- Certains résultats sont manquants ou approximatifs (un jour positif le lendemain négatif) : biais
- Etc, etc...
Une analyse complète est ici : https://scienceintegritydigest.com/2020/03/24/thoughts-on-the-gautret-et-al-paper-about-hydroxychloroquine-and-azithromycin-treatment-of-covid-19-infections/
Ou">https://scienceintegritydigest.com/2020/03/2... dans ce thread ici : https://twitter.com/tsarorius/status/1240429725941731328?s=21
Bref">https://twitter.com/tsarorius... il est très hasardeux de pouvoir conclure quelque chose et d’avoir une idée de l’efficacité avec cette seule étude.
Ou">https://scienceintegritydigest.com/2020/03/2... dans ce thread ici : https://twitter.com/tsarorius/status/1240429725941731328?s=21
Bref">https://twitter.com/tsarorius... il est très hasardeux de pouvoir conclure quelque chose et d’avoir une idée de l’efficacité avec cette seule étude.
La 2ème étude maintenant : https://www.mediterranee-infection.com/wp-content/uploads/2020/03/COVID-IHU-2-1.pdf
-">https://www.mediterranee-infection.com/wp-conten... 80 patients, c’est mieux
- Mais (et c’est un énorme MAIS) il n’y a pas de groupe contrôle... https://abs.twimg.com/emoji/v2/... draggable="false" alt="😧" title="Anguished face" aria-label="Emoji: Anguished face">
https://abs.twimg.com/emoji/v2/... draggable="false" alt="😧" title="Anguished face" aria-label="Emoji: Anguished face"> https://abs.twimg.com/emoji/v2/... draggable="false" alt="🤦♂️" title="Man facepalming" aria-label="Emoji: Man facepalming">
https://abs.twimg.com/emoji/v2/... draggable="false" alt="🤦♂️" title="Man facepalming" aria-label="Emoji: Man facepalming">
-">https://www.mediterranee-infection.com/wp-conten... 80 patients, c’est mieux
- Mais (et c’est un énorme MAIS) il n’y a pas de groupe contrôle...
Si vous avez suivi ce que j’ai raconté plus haut, ça veut dire qu’on ne peut faire de comparaison, et donc qu’on ne peut absolument pas savoir si le traitement est efficace ni s’il est bénéfique...
Donc dans le contexte actuel, si cette étude ne vaut pas zéro, elle n’en est pas loin.
Une analyse plus complète ici : https://twitter.com/t_fiolet/status/1243651225574309888?s=21">https://twitter.com/t_fiolet/...
Une analyse plus complète ici : https://twitter.com/t_fiolet/status/1243651225574309888?s=21">https://twitter.com/t_fiolet/...
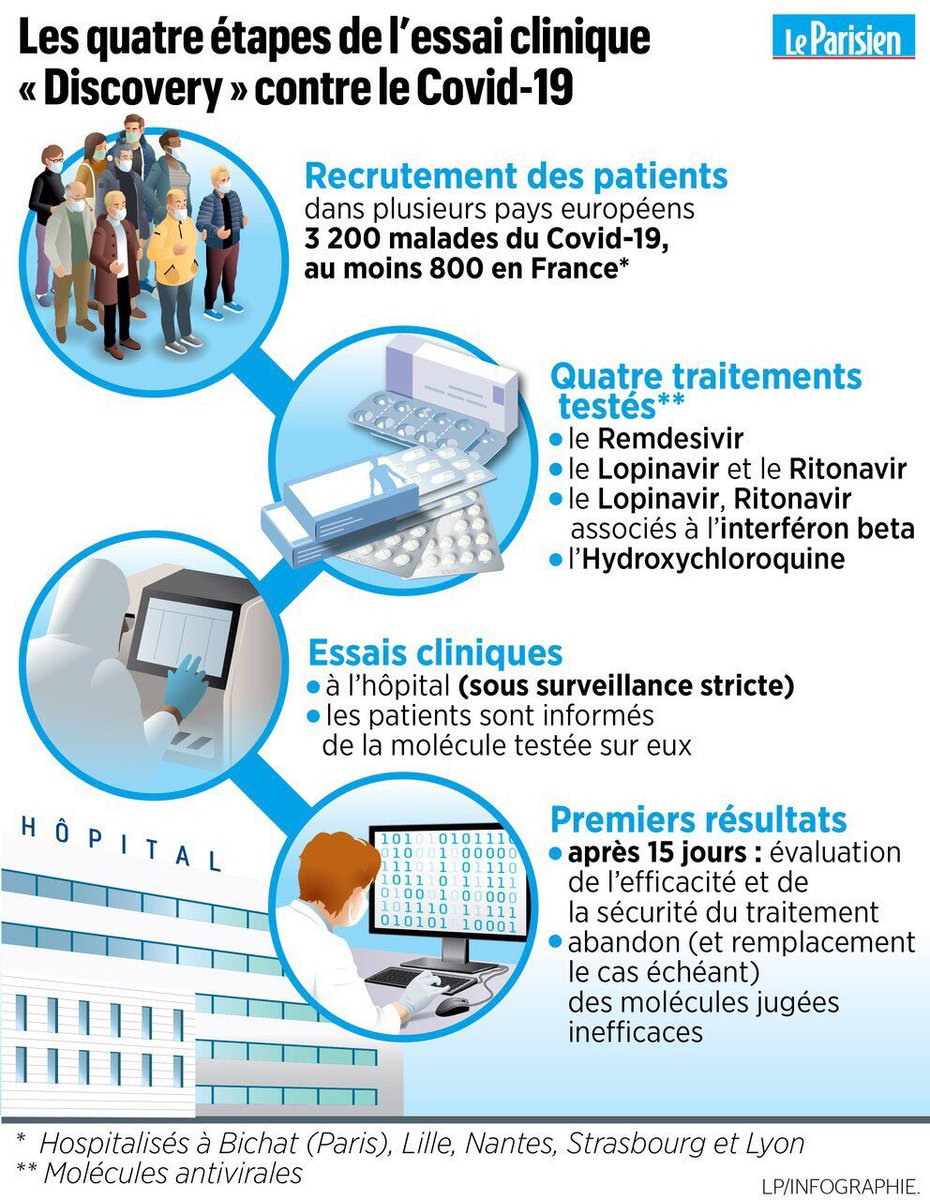
Vous savez que sur recommandation de l’OMS, l’Europe a lancé un essai clinique à large échelle du nom de Discovery, dans lequel la France a un rôle très important.
https://presse.inserm.fr/lancement-dun-essai-clinique-europeen-contre-le-covid-19/38737/">https://presse.inserm.fr/lancement...
https://presse.inserm.fr/lancement-dun-essai-clinique-europeen-contre-le-covid-19/38737/">https://presse.inserm.fr/lancement...
Cet essai monté en un temps record a pour but d’éviter ce qui s’est passé en Afrique de l’Ouest pendant l’épidémie d’Ebola en 2014-2015 : mauvaises coordinations et priorisations, et des études variables empêchant l’évaluation correcte des traitements.
https://nam.edu/wp-content/uploads/2016/01/Neglected-Dimension-of-Global-Security.pdf">https://nam.edu/wp-conten...
https://nam.edu/wp-content/uploads/2016/01/Neglected-Dimension-of-Global-Security.pdf">https://nam.edu/wp-conten...
Pour Discovery c’est tout le contraire :
- Objectif de 3200 patients dans toute l’Europe (dont 800 en France)
- 4 traitements testés en parallèle (dont le remdesivir et l’hydroxychloroquine) + 1 groupe de contrôle
- Objectif de 3200 patients dans toute l’Europe (dont 800 en France)
- 4 traitements testés en parallèle (dont le remdesivir et l’hydroxychloroquine) + 1 groupe de contrôle
- Essai randomisé (attribution aléatoire des traitements)
- Patients et médecins sauront quel traitement est utilisé (pas de double aveugle)
- Patients et médecins sauront quel traitement est utilisé (pas de double aveugle)
Pourquoi pas de double aveugle ?
Je ne sais pas https://abs.twimg.com/emoji/v2/... draggable="false" alt="🤷♂️" title="Man shrugging" aria-label="Emoji: Man shrugging"> mais je dirais que les critères doivent être suffisamment objectifs, et aussi pour des questions de logistique ou d’organisation, vu la taille de l’étude et la vitesse à laquelle elle doit être exécutée.
https://abs.twimg.com/emoji/v2/... draggable="false" alt="🤷♂️" title="Man shrugging" aria-label="Emoji: Man shrugging"> mais je dirais que les critères doivent être suffisamment objectifs, et aussi pour des questions de logistique ou d’organisation, vu la taille de l’étude et la vitesse à laquelle elle doit être exécutée.
Je ne sais pas
L’hydroxychloroquine initialement non prévue a été rajoutée mi-mars pour être évaluée formellement suite à d’autres recommandations de l’OMS, au vu des essais in vitro prometteurs et de l’efficacité possible de ce traitement sur des patients.
https://www.who.int/blueprint/priority-diseases/key-action/RD-Blueprint-expert-group-on-CQ-call-Mar-13-2020.pdf?ua=1">https://www.who.int/blueprint...
https://www.who.int/blueprint/priority-diseases/key-action/RD-Blueprint-expert-group-on-CQ-call-Mar-13-2020.pdf?ua=1">https://www.who.int/blueprint...
C’est un essai adaptatif, c’est à dire que si un nouveau traitement apparaît ou si l’un montre vite une meilleure efficacité, l’essai sera modifié en cours de route, pour converger plus rapidement vers la meilleure solution.
Très bonnes explications ici : https://youtu.be/PwCDoxOh0Aw ">https://youtu.be/PwCDoxOh0...
Très bonnes explications ici : https://youtu.be/PwCDoxOh0Aw ">https://youtu.be/PwCDoxOh0...
Les premiers patients ont été inclus il y a une semaine et la première évaluation a lieu au bout de 15 jours, donc les premiers résultats préliminaires sont à attendre d’ici ~2 semaines.
Et ENFIN on pourra être VRAIMENT fixé sur l’efficacité ou non de la chloroquine et des autres traitements.
Parce que là avec la chloroquine, au delà du brouhaha médiatique et des effets d’annonces, en fait on n’en sait rien...
Parce que là avec la chloroquine, au delà du brouhaha médiatique et des effets d’annonces, en fait on n’en sait rien...
Voir pour exemple cette étude chinoise similaire à celle de l’équipe de Raoult mais mieux exécutée (30 patients, randomisée, et plus de critères), qui n’a montré aucune différence entre le groupe traité et le groupe de contrôle...  https://abs.twimg.com/emoji/v2/... draggable="false" alt="🤷♂️" title="Man shrugging" aria-label="Emoji: Man shrugging">
https://abs.twimg.com/emoji/v2/... draggable="false" alt="🤷♂️" title="Man shrugging" aria-label="Emoji: Man shrugging">
http://www.zjujournals.com/med/EN/10.3785/j.issn.1008-9292.2020.03.03">https://www.zjujournals.com/med/EN/10...
http://www.zjujournals.com/med/EN/10.3785/j.issn.1008-9292.2020.03.03">https://www.zjujournals.com/med/EN/10...
C’est le moment de terminer ce thread, j’espère que vous avez appris des trucs et que vous comprenez mieux les enjeux d’attendre des études fiables avant de distribuer un traitement non testé à la terre entière  https://abs.twimg.com/emoji/v2/... draggable="false" alt="😊" title="Smiling face with smiling eyes" aria-label="Emoji: Smiling face with smiling eyes">
https://abs.twimg.com/emoji/v2/... draggable="false" alt="😊" title="Smiling face with smiling eyes" aria-label="Emoji: Smiling face with smiling eyes"> https://abs.twimg.com/emoji/v2/... draggable="false" alt="🌏" title="Earth globe asia-australia" aria-label="Emoji: Earth globe asia-australia">
https://abs.twimg.com/emoji/v2/... draggable="false" alt="🌏" title="Earth globe asia-australia" aria-label="Emoji: Earth globe asia-australia"> https://abs.twimg.com/emoji/v2/... draggable="false" alt="🌍" title="Earth globe europe-africa" aria-label="Emoji: Earth globe europe-africa">
https://abs.twimg.com/emoji/v2/... draggable="false" alt="🌍" title="Earth globe europe-africa" aria-label="Emoji: Earth globe europe-africa"> https://abs.twimg.com/emoji/v2/... draggable="false" alt="🌎" title="Earth globe americas" aria-label="Emoji: Earth globe americas">
https://abs.twimg.com/emoji/v2/... draggable="false" alt="🌎" title="Earth globe americas" aria-label="Emoji: Earth globe americas">
Le mot de la fin sera pour vous amener à regarder cette excellente vidéo de @le_science4all :
https://youtu.be/I-n2OU78Ck8
« Prendre">https://youtu.be/I-n2OU78C... des échantillons trop petits, et conclure trop tôt, c’est indirectement, potentiellement, sacrifier des centaines de milliers de vies »
#Fin
https://youtu.be/I-n2OU78Ck8
« Prendre">https://youtu.be/I-n2OU78C... des échantillons trop petits, et conclure trop tôt, c’est indirectement, potentiellement, sacrifier des centaines de milliers de vies »
#Fin
Ah, on m’informe dans mon oreillette qu’une nouvelle étude chinoise vient d’être pré-publiée, et que, effectuée de manière rigoureuse, elle montre une efficacité de l’hydroxychloroquine sur des patients atteints du covid-19. https://www.medrxiv.org/content/10.1101/2020.03.22.20040758v1">https://www.medrxiv.org/content/1...
C’est donc une preuve de plus qu’il fallait inclure l’hydroxychloroquine dans l’essai Discovery qui permettra de confirmer ou non ces résultats encourageants.
Les auteurs le disent d’ailleurs eux-mêmes dès le début :
« Cet article [...] fait état de nouvelles recherches médicales qui n& #39;ont pas encore été évaluées et ne doivent donc PAS être utilisées pour guider la pratique clinique. »
« Cet article [...] fait état de nouvelles recherches médicales qui n& #39;ont pas encore été évaluées et ne doivent donc PAS être utilisées pour guider la pratique clinique. »
Une analyse plus poussée de cette étude ici, qui vient confirmer sa rigueur et son intérêt : https://twitter.com/colingiacobi/status/1244956105802801152?s=21">https://twitter.com/colingiac...

 Read on Twitter
Read on Twitter Si vous n’y voyez pas clair dans tout ça, j’ai essayé de remettre les choses dans l’ordre, avec un peu de recul. #Thread https://abs.twimg.com/emoji/v2/... draggable="false" alt="⬇️" title="Downwards arrow" aria-label="Emoji: Downwards arrow">https://abs.twimg.com/emoji/v2/... draggable="false" alt="⬇️" title="Downwards arrow" aria-label="Emoji: Downwards arrow">" title="À moins d’être confiné dans une grotte, vous avez tous entendu parler de chloroquine, des études de Raoult, d’essai randomisé, et de double aveugle https://abs.twimg.com/emoji/v2/... draggable="false" alt="🧐" title="Face with monocle" aria-label="Emoji: Face with monocle">Si vous n’y voyez pas clair dans tout ça, j’ai essayé de remettre les choses dans l’ordre, avec un peu de recul. #Thread https://abs.twimg.com/emoji/v2/... draggable="false" alt="⬇️" title="Downwards arrow" aria-label="Emoji: Downwards arrow">https://abs.twimg.com/emoji/v2/... draggable="false" alt="⬇️" title="Downwards arrow" aria-label="Emoji: Downwards arrow">" class="img-responsive" style="max-width:100%;"/>
Si vous n’y voyez pas clair dans tout ça, j’ai essayé de remettre les choses dans l’ordre, avec un peu de recul. #Thread https://abs.twimg.com/emoji/v2/... draggable="false" alt="⬇️" title="Downwards arrow" aria-label="Emoji: Downwards arrow">https://abs.twimg.com/emoji/v2/... draggable="false" alt="⬇️" title="Downwards arrow" aria-label="Emoji: Downwards arrow">" title="À moins d’être confiné dans une grotte, vous avez tous entendu parler de chloroquine, des études de Raoult, d’essai randomisé, et de double aveugle https://abs.twimg.com/emoji/v2/... draggable="false" alt="🧐" title="Face with monocle" aria-label="Emoji: Face with monocle">Si vous n’y voyez pas clair dans tout ça, j’ai essayé de remettre les choses dans l’ordre, avec un peu de recul. #Thread https://abs.twimg.com/emoji/v2/... draggable="false" alt="⬇️" title="Downwards arrow" aria-label="Emoji: Downwards arrow">https://abs.twimg.com/emoji/v2/... draggable="false" alt="⬇️" title="Downwards arrow" aria-label="Emoji: Downwards arrow">" class="img-responsive" style="max-width:100%;"/>





 , et que le patient ne sache pas quel traitement il reçoit https://abs.twimg.com/emoji/v2/... draggable="false" alt="🙈" title="See-no-evil monkey" aria-label="Emoji: See-no-evil monkey">On parle alors d’étude en "double aveugle" https://abs.twimg.com/emoji/v2/... draggable="false" alt="🙈" title="See-no-evil monkey" aria-label="Emoji: See-no-evil monkey">https://abs.twimg.com/emoji/v2/... draggable="false" alt="🙈" title="See-no-evil monkey" aria-label="Emoji: See-no-evil monkey">" title="Une fois les patients répartis, on déroule l’essai.Pour éviter là aussi des biais, le mieux est que le soignant ne sache pas quel traitement il donne https://abs.twimg.com/emoji/v2/... draggable="false" alt="🙈" title="See-no-evil monkey" aria-label="Emoji: See-no-evil monkey">, et que le patient ne sache pas quel traitement il reçoit https://abs.twimg.com/emoji/v2/... draggable="false" alt="🙈" title="See-no-evil monkey" aria-label="Emoji: See-no-evil monkey">On parle alors d’étude en "double aveugle" https://abs.twimg.com/emoji/v2/... draggable="false" alt="🙈" title="See-no-evil monkey" aria-label="Emoji: See-no-evil monkey">https://abs.twimg.com/emoji/v2/... draggable="false" alt="🙈" title="See-no-evil monkey" aria-label="Emoji: See-no-evil monkey">" class="img-responsive" style="max-width:100%;"/>
, et que le patient ne sache pas quel traitement il reçoit https://abs.twimg.com/emoji/v2/... draggable="false" alt="🙈" title="See-no-evil monkey" aria-label="Emoji: See-no-evil monkey">On parle alors d’étude en "double aveugle" https://abs.twimg.com/emoji/v2/... draggable="false" alt="🙈" title="See-no-evil monkey" aria-label="Emoji: See-no-evil monkey">https://abs.twimg.com/emoji/v2/... draggable="false" alt="🙈" title="See-no-evil monkey" aria-label="Emoji: See-no-evil monkey">" title="Une fois les patients répartis, on déroule l’essai.Pour éviter là aussi des biais, le mieux est que le soignant ne sache pas quel traitement il donne https://abs.twimg.com/emoji/v2/... draggable="false" alt="🙈" title="See-no-evil monkey" aria-label="Emoji: See-no-evil monkey">, et que le patient ne sache pas quel traitement il reçoit https://abs.twimg.com/emoji/v2/... draggable="false" alt="🙈" title="See-no-evil monkey" aria-label="Emoji: See-no-evil monkey">On parle alors d’étude en "double aveugle" https://abs.twimg.com/emoji/v2/... draggable="false" alt="🙈" title="See-no-evil monkey" aria-label="Emoji: See-no-evil monkey">https://abs.twimg.com/emoji/v2/... draggable="false" alt="🙈" title="See-no-evil monkey" aria-label="Emoji: See-no-evil monkey">" class="img-responsive" style="max-width:100%;"/>